Summary:
上海2021年4月22日 /美通社/ -- 2021年4月22日,復宏漢霖(2696.HK)宣佈,自主研製的創新型PD-1抑制劑斯魯利單抗注射液(HLX10)針對經標準治療失敗的、不可切除或轉移性高度微衛星不穩定型(Microsatellite Instability-High, MSI-H)實體瘤適應症的上市註冊申請(NDA)正式獲得國家藥品監督管理局(NMPA)受理,並擬納入優先審評程序,有望成為國內首個治療MSI-H實體瘤的抗PD-1單抗。該適應症依據特定的MSI-H腫瘤標誌物進行篩查,不以癌種進行區分,覆蓋患者群體廣泛。圍繞斯魯利單抗,公司採取了「Combo+Global」(聯合治療+國際化)的差異化開發戰略,在適應症選擇和聯合治療上重點發力,已於全球範圍內同步開展10項臨床試驗。
斯魯利單抗單藥治療高度微衛星不穩定型或錯配修復缺陷型(MSI-H/dMMR)實體瘤的II期臨床研究聯合主要研究者,南京金陵醫院腫瘤中心秦叔逵教授表示:「斯魯利單抗在臨床前研究和早期臨床研究中已展現出優秀的抗腫瘤活性,本次針對MSI-H實體瘤的II期臨床研究結果顯示產品療效及安全性優異。期待質量、療效均有保證的國產創新型PD-1抑制劑早日上市,讓更多MSI-H實體瘤患者獲得高品質的免疫治療新選擇。」
復宏漢霖執行董事、首席執行官兼總裁張文傑先生表示:「斯魯利單抗是復宏漢霖核心創新單抗產品,公司對其實施差異化開發,重點佈局免疫聯合療法和國際臨床研究,現各項研究正在加速推進中。斯魯利單抗的NDA受理離不開所有受試者、研究人員的支持以及團隊各位同事的努力,我們將盡快推進該產品更多適應症的上市進程,持續開拓海外市場,惠及更多患者。」
適應症全面覆蓋高發癌種,多項研究進入關鍵臨床3期
圍繞「Combo+Global」的戰略部署,目前公司已開展斯魯利單抗的2項單藥及8項聯合療法臨床試驗,積極就化療、自有VEGF、EGFR靶點單抗等治療方案進行免疫聯合療法,不僅全面覆蓋了肺癌、食管癌、肝細胞癌、胃癌、頭頸癌等高發大瘤種,並針對中國的癌症發病人群特點實施差異化臨床開發。其中,胃癌新輔助/輔助領域中PD-1抑制劑相關的探索較少,復宏漢霖聚焦該適應症開展3期臨床研究,在這一細分領域上處於國際領先地位,有望使胃癌患者在前線便從腫瘤免疫療法中獲益。此外,針對一線鱗狀非小細胞肺癌、一線非鱗狀非小細胞肺癌及一線小細胞肺癌的斯魯利單抗聯合治療均已進入關鍵性3期研究階段,在肺癌一線治療中實現了全面佈局。斯魯利單抗聯合化療一線治療鱗狀非小細胞肺癌的上市註冊申請有望於今年下半年遞交。
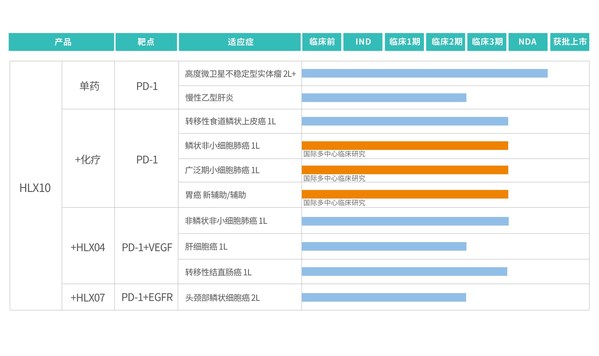
斯魯利單抗(HLX10)臨床研究進展
多方位國際化佈局,惠及新興國家市場
斯魯利單抗的研發嚴格按照國際標準,該產品的生產基地已通過歐盟和中國的GMP認證。公司針對斯魯利單抗前瞻性地進行了國際佈局,已於中國、美國、歐盟等國家和地區獲得批准開展臨床試驗,並於中國、土耳其、波蘭、烏克蘭、俄羅斯等國家及地區累計入組近2000名受試者,印證了國際市場對公司產品質量的信心與認可。同時,復宏漢霖也希望憑借豐富的國際臨床研究數據,通過國際合作等方式惠及歐盟、美國及新興市場的更多患者。目前,公司已與PT Kalbe Genexine Biologics(KG Bio)達成合作協議,授予其斯魯利單抗首個單藥療法及兩項聯合療法在東南亞地區10個國家的獨家開發和商業化權利。
隨著「Combo+Global」戰略的不斷深入,以斯魯利單抗為先導,復宏漢霖持續打造豐富的創新藥候選產品管線,積極加速多元化創新,提高創新效率,致力於持續為全球患者帶來可負擔的高品質創新生物藥。
關於MSI-H實體瘤
微衛星不穩定通常由於基因的錯配修復功能缺失,使DNA複製過程中微衛星序列鹼基插入或錯配,造成錯誤鹼基累積所致[1]。其中,高度微衛星不穩定常發生在多個癌種中,如子宮內膜癌、結直腸癌、胃癌、腎細胞癌、卵巢癌等[2],有研究顯示MSI-H在所有癌種中的發生率約為14%[3],該類患者通常對於免疫檢查點抑制劑有較高的應答率[4-5],MSI-H也越來越成為預測實體瘤患者免疫治療效果的重要生物標誌物。若患者被檢測出這一腫瘤標誌物呈陽性且符合治療標準,即可進行相應的腫瘤免疫治療,而不需要按照傳統的腫瘤原發灶部位與病理分型對患者進行篩選,符合精準治療的先進理念,適用癌種範圍廣泛。目前美國食品藥品監督管理局(US FDA)已批准PD-1靶點藥物用於治療既往一線標準治療失敗的MSI-H/dMMR晚期實體瘤及一、二線MSI-H/dMMR結直腸癌等適應症,我國尚未有針對MSI-H/dMMR晚期實體瘤獲批的抗PD-1單抗,治療需求遠未被滿足。
關於復宏漢霖
復宏漢霖(2696.HK)是一家國際化的創新生物製藥公司,致力於為全球患者提供可負擔的高品質生物藥,產品覆蓋腫瘤、自身免疫疾病、眼科疾病等領域,已在中國上市3款產品,在歐盟上市1款產品,3款產品獲得中國上市註冊申請受理。自2010年成立以來,復宏漢霖已建成一體化生物製藥平台,高效及創新的自主核心能力貫穿研發、生產及商業運營全產業鏈。公司已建立完善高效的全球研發中心,按照國際GMP標準進行生產和質量管控,位於上海徐匯的生產基地已獲得中國和歐盟GMP認證。
復宏漢霖前瞻性佈局了一個多元化、高質量的產品管線,涵蓋20多種創新單克隆抗體,並全面推進基於自有抗PD-1單抗斯魯利單抗的腫瘤免疫聯合療法。繼國內首個生物類似藥漢利康®(利妥昔單抗)、中國首個自主研發的中歐雙批單抗藥物漢曲優®(曲妥珠單抗,歐盟商品名:Zercepac®)、公司首個自身免疫疾病治療產品漢達遠®(阿達木單抗)相繼獲批上市,公司HLX04貝伐珠單抗及兩款創新藥HLX01利妥昔單抗類風濕關節炎新適應症、斯魯利單抗MSI-H實體瘤的上市註冊申請也正在審評中。公司亦同步就10個產品、8個聯合治療方案在全球範圍內開展20多項臨床試驗,對外授權全面覆蓋歐美主流生物藥市場和眾多新興國家市場。
參考文獻:
[1] Yang G, Zheng RY, Jin ZS. Correlations between microsatellite instability and the biological behaviour of tumours. J Cancer Res Clin Oncol.2019 Dec;145(12):2891-2899.
[2] Hause, R., Pritchard, C., Shendure, J. et al. Classification and characterization of microsatellite instability across 18 cancer types. Nat Med22, 1342–1350 (2016).
[3] Lorenzi M, Amonkar M, Zhang J, et al. Epidemiology of Microsatellite Instability High (MSI-H) and Deficient Mismatch Repair (dMMR) in Solid Tumors: A Structured Literature Review[J]. Journal of Oncology, 2020,2020.
[4] Michael J Overman, Ray McDermott, Joseph L Leach, et al. Nivolumab in patients with metastatic DNA mismatch repair deficient/microsatellite instability-high colorectal cancer (CheckMate 142): results of an open-label, multicenter, phase 2 study[J]. Lancet Oncology, 2017,18(9):1182-1191.
[5] Aurelien Marabelle, Dung T Le, Paolo A Asciert, et al. Efficacy of Pembrolizumab in Patients With Noncolorectal High Microsatellite Instability/Mismatch Repair-Deficient Cancer: Results From the Phase IIKEYNOTE-158 Study[J]. J Clin Oncol, 2020, 38(1): 1-10.
相關鏈接 :
http://www.henlius.com