創建國研醫材創價聯盟
對於有意願進入生醫產業的新創團隊,需面對重重關卡,往返作業上往往曠日廢時。為協助新創團隊通關,加速台灣生技醫療器材產品化,國研院於2014年底攜手產官學研醫各界所組成之「國研醫材創價聯盟」,串接醫療電子、高分子醫材及金屬醫材三大醫材技術能量,從剛開始的20個單位,現已增至40多家聯盟成員專業分工與平台整合,由服務窗口指派專人帶領新創團隊走完前述流程,持續強化「一條龍」的通關服務。
此外,還為新創團隊媒合投資者提供專業財務會計及上市櫃諮詢與輔導,以達到促進新創醫材產品快速商品化的目標,協助新創團隊的產品順利從「創新」跨入「創價」,引領國內醫療器材產業上衝兆元產值。
我國醫療器材產業發展以「創新、高值」為目標,未來結合台灣既有的醫療服務與資通訊技術優勢,可望再為產業加值、產值翻倍。

儀科中心建置一站式的服務平台,協助研發團隊進行醫電產品的開發與製作、安規檢測驗證、電磁相容測試等,圖為電性安規驗證的實驗室之一。
亞洲唯一3D列印醫材驗證機構
儀科中心2014年設立「3D列印聯合實驗室」,致力推動原物料與設備國產化,成為國內最完整之生醫材料積層列印平台。高博士表示,3D列印最重要的價值在原型製造,可大幅減少過去模型製作所耗費的大量經費及時程,目前已協助催生台灣第一家通過生物相容性測試之生醫等級3D金屬列印粉末製造商鑫科材料公司,結合國內東台精機公司研發之3D金屬列印設備,透過聯合骨科公司生產之醫材產品,成功通過嚴峻的ISO-10993生物相容性國際法規驗證、機械特性確效,備受矚目。除了前項驗證項目優勢外,並與國研院動物中心合作建構臨床前試驗,一舉成為國際權威產品安全認證機構 UL公司全球首家授權、也是目前亞洲唯一之3D列印醫材驗證機構,可解決3D列印醫材上市前90%的驗證關卡問題,協助廠商申請上市許可的時間及經費至少縮減一半,不僅加速醫材上市,也有助於提升醫療水平。
在取得美國FDA上市許可前,3D列印醫材產品必須依據醫療器材預期用途,取得生物相容性驗證、機械特性確效、臨床前試驗及人體試驗等4項認證。UL公司是美國FDA法規事務辦公室的獨家合作夥伴,取得UL公司的認證,等同加速取得FDA認證。各國廠商只要將3D列印醫材產品送至儀科中心,產品通過儀科中心前3項的驗證後,只要接續進行人體試驗並通過FDA認證,即可取得在美國上市的許可。

儀科中心成為3D列印醫材驗證機構,可協助生醫產業解決3D列印醫材上市前90%的驗證關卡問題,加速醫材上市。
開拓生醫新世代大商機
研發中心以臨床醫療需求為導向,以鄰近大新竹地區電子、資訊通訊、光電與相關研究之優勢為基礎,結合ICT產業、新竹園區IC設計及製造產業與生物醫學之異業技術,發展產學研界之共同醫材技術及研發服務平台,使新竹生醫園區成為國內生醫產業之領航園區。高博士表示,生醫園區許多醫材產業的優異人才很多來自於竹科ICT大廠,其實關鍵技術、所使用的設施很多是類似的,只是在觀念上要從「IC量產」,轉為「少量多樣」的方式。
高博士表示,台灣醫療技術在國際間向來受到高度關注,在全球前200大醫院中,台灣就占了14家,僅次於美國及德國,排名全球第3,亞洲第1。2017年國際生技大會(BIO International Convention)的報告中,台灣更在新興市場生醫投資指數中名列第3,超越南韓、馬來西亞及印度,但台灣的生醫產值卻微乎其微,這個大落差需要大家一起努力拉近。
儀科中心歡迎各界運用其生醫設施及資源,同時將持續透過研究資源共享及臨床實務之應用,與台大園區醫院相輔相成,並與周邊大學及相關研究單位建立良好的合作關係與互動,確保優秀人才之獲得。如此結合學術、臨床醫學及產業之研究能量,有助於我國生醫科技及病患治療技術的發展,進而提高醫療品質和產業競爭力,迎接生醫新世代的大商機。
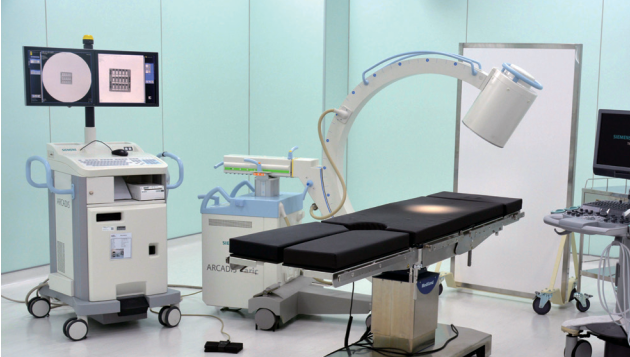
儀科中心的生醫影像核心實驗室。圖中的C-arm + 超音波有三個用途:1.軟硬組織造影與臨床前試驗之術後追蹤 2.手術導引醫療器材研發測試實驗 3.醫療器材可用性評估測試。
摘自《科技生活雜誌》10月號 206期 文/林芝華‧許佩玟 圖/黃國倉攝‧國研院儀科中心提供